基于T细胞的免疫疗法因其在癌症治疗中的潜在潜力而备受关注,特别是在2017年美国食品药品监督管理局(FDA)批准了第一种嵌合抗原受体(CAR)T细胞疗法之后。CAR T细胞治疗的成功取决于功能性T细胞的体外扩增和T细胞活化促进的CAR工程基因的有效转移。因此,学术界和医疗行业都需要一种强大而有效的激活和扩增T细胞的方案。
典型的体外T细胞活化和扩增方案需要T细胞受体(TCR)刺激、配体共刺激和促生存细胞因子补充(通常是白细胞介素-2(IL-2))。目前常规的体外T细胞扩增方法使用固定在平板基质或磁性微珠(Beads3/28、Dynabeads、Thermo Fisher)上的单克隆抗CD3(αCD3)和抗CD28(αCD28),以及外部补充的IL-2。先进的抗原呈递平台(APP)已经显示出通过更好地模拟抗原呈递细胞(APC)的自然结构和功能来提高T细胞扩增效率的潜力。例子包括介孔二氧化硅纳米棒和碳纳米管-聚合物复合材料上的流体脂质双层。然而,这些先进的APP,包括Beads3/28,具有刚性结构,限制了免疫突触中的大表面接触形成,阻碍了体内T细胞活化的完全模拟。例如,虽然体内T细胞活化可以诱导T细胞大量分泌IL-2以实现自主增殖,但当代体外APP仍然需要外部IL-2补充,这突显了当前方法与通过与APC形成免疫突触实现的自然T细胞活化之间的差距。为了优化体外T细胞扩增,先进的APP应该为适应性细胞表面相互作用提供实质性的表面接触和灵活性。二维材料,如氧化石墨烯,以其高柔性和巨大的表面改性潜力而闻名,是APP的理想候选材料。先前的研究表明,纳米氧化石墨烯薄片和石墨烯量子点可以被修饰以携带药物分子或抗体,用于生物医学应用。
鉴于此,加州大学洛杉矶分校Yu Huang、Lili Yang等研究人员开发了一种细胞大小的高度柔性氧化石墨烯(GO)APP(GO-APP),它通过共形接合比其他现有方法更有效地模拟体内免疫突触。研究人员使用柔性聚乙二醇(PEG)连接体将αCD3和αCD28与柔性GO片结合,在GO-APP3/28构建体中建立了层次灵活性。这种设计为αCD3和αCD28的同时参与提供了广泛的界面区域和增强的可访问性,从而实现了卓越的T细胞激活。

氧化石墨烯APP的设计与表征
研究人员通过改进的Hummer方法合成了氧化石墨烯(GO)片,尺寸为11.8±2.6μm,厚度为1.0±0.2 nm,具有出色的柔韧性。GO表面通过氯乙酸处理引入羧基,并通过紫外-可见光谱验证了功能化成功。接着,研究人员通过EDC/NHS偶联将MAL-PEG-NH2连接子与GO结合,然后连接硫醇化链霉亲和素,最终与生物素化的αCD3和αCD28抗体结合,抗体密度约为每μm² GO 1119分子。
GO-APP3/28被优化以模拟真实的免疫突触,需要CD3和CD28的同时激活以有效激活T细胞。设计中的αCD3和αCD28密度符合人类生理TCR和CD28密度要求。GO-APP3/28与T细胞的接触面积为75.82±2.59 μm²,与APC和T细胞之间的免疫突触面积相似,远大于商业Beads3/28的接触面积。研究人员发现,GO-APP3/28片过大或过小都会减少T细胞扩增。GO-APP3/28的最佳浓度为0.1 μg/mL,这与商业Beads3/28的最佳浓度一致,且在这个浓度下,大多数T细胞与GO-APP3/28接触。
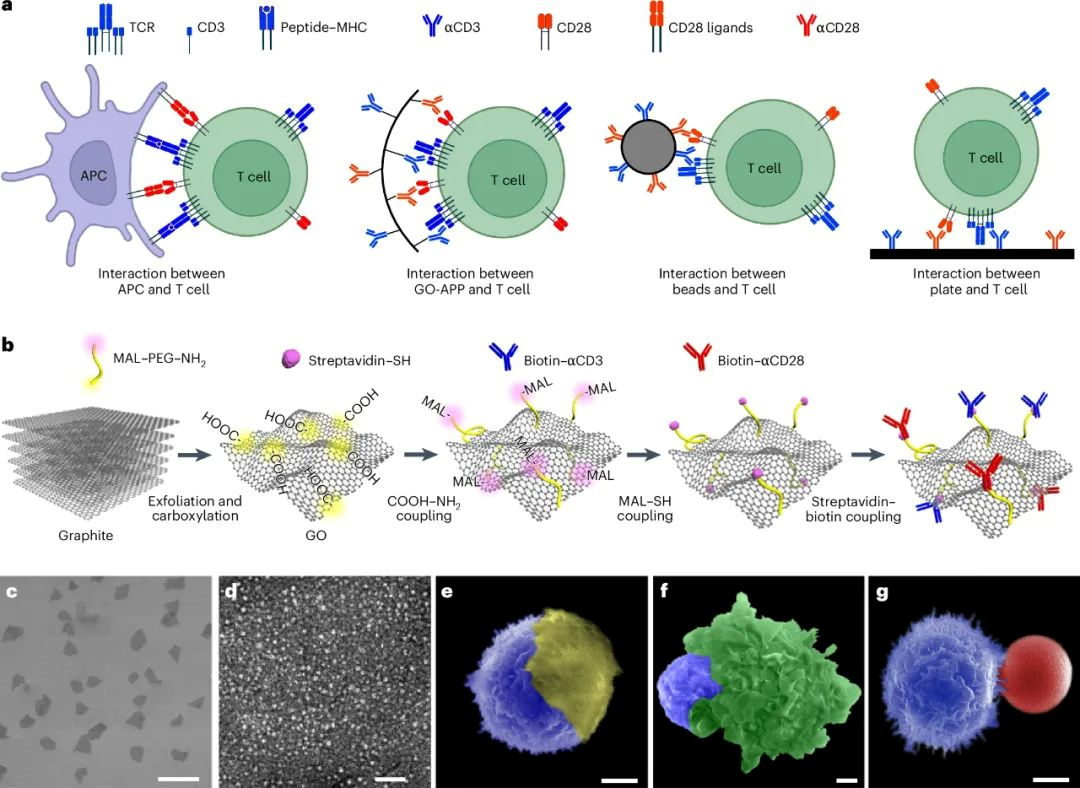
图1 | 设计和表征用于展示αCD3和αCD28(GO-APP3/28)的细胞尺寸氧化石墨烯(GO)平台
GO-APP3/28在T细胞培养和CAR T细胞制造中的应用
GO-APP3/28在体外实验中显示出比Beads3/28和其他对照方法更优的T细胞激活和扩增能力,即使在没有IL-2补充的情况下。GO-APP3/28激活的T细胞产生更多IL-2和IFNγ,并且CD4+T细胞比例更高。通过MACS分离的CD4+和CD8+ T细胞在GO-APP3/28激活下扩增更好。GO-APP3/28还提高了CAR T细胞的转导效率,减少了病毒载体的使用,降低了制造成本,最终提高了CAR T细胞的产量。这些发现表明GO-APP3/28在CAR T细胞治疗中具有潜在的应用价值。
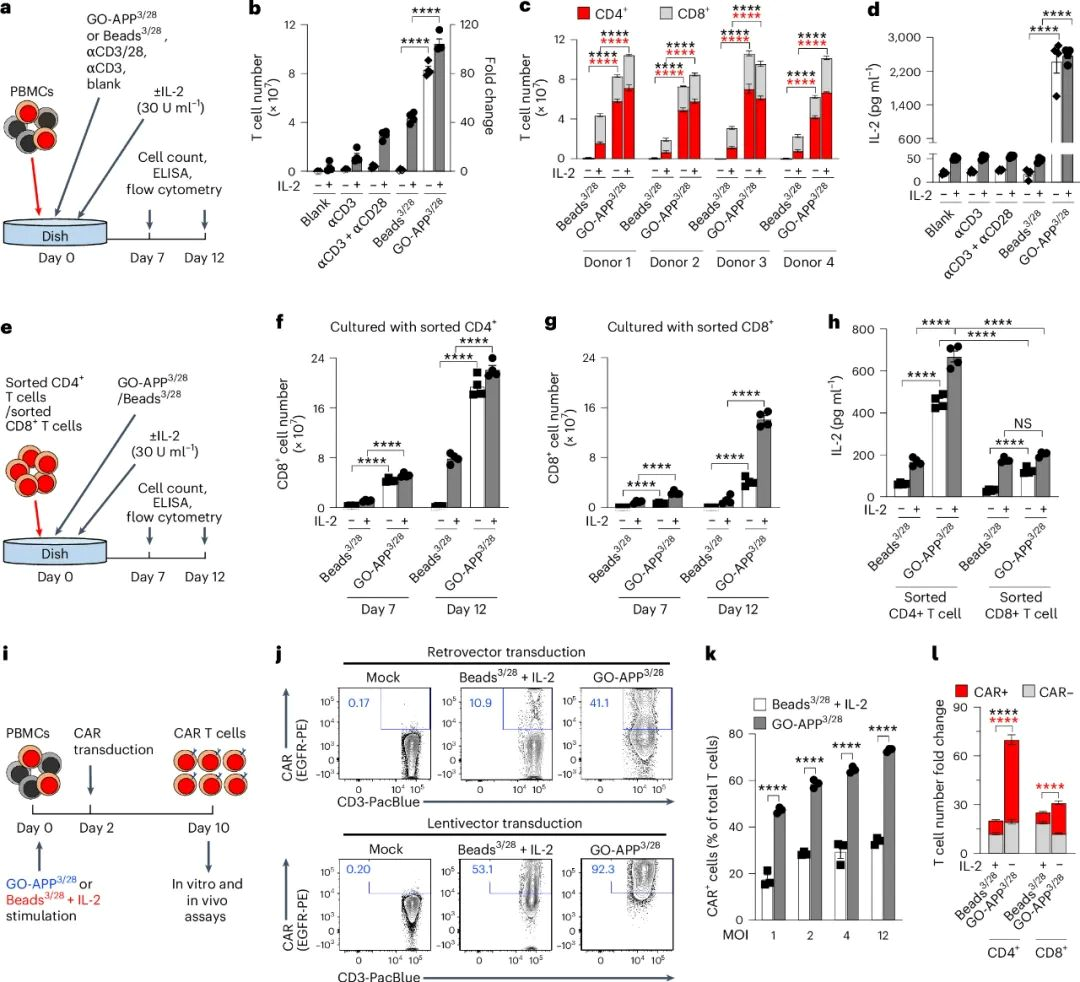
图2 | GO-APP3/28在T细胞培养和CAR T细胞生产中的应用
GO-APP3/28在CAR T细胞癌症治疗中的作用
GO-APP3/28CAR T细胞在体外和体内的肿瘤杀伤实验中表现优于Beads3/28 CAR T细胞。在短期实验中,GO-APP3/28CAR T细胞显示出更强的杀伤能力,这可能与它们更好的CAR转导效率有关。在连续肿瘤杀伤实验中,GO-APP3/28 CAR T细胞在肿瘤再挑战后的第3天和第5天的肿瘤抑制效果更好。在Raji淋巴瘤小鼠模型中,GO-APP3/28 CAR T细胞治疗的小鼠生存时间更长,肿瘤负荷更低,且在各种组织中的持久性更高。在更复杂的AsPC-1胰腺癌模型中,GO-APP3/28 CAR T细胞同样显示出更好的肿瘤抑制效果和T细胞持久性。这些结果表明,GO-APP3/28 CAR T细胞在抗癌细胞治疗中具有显著的疗效和持久性。
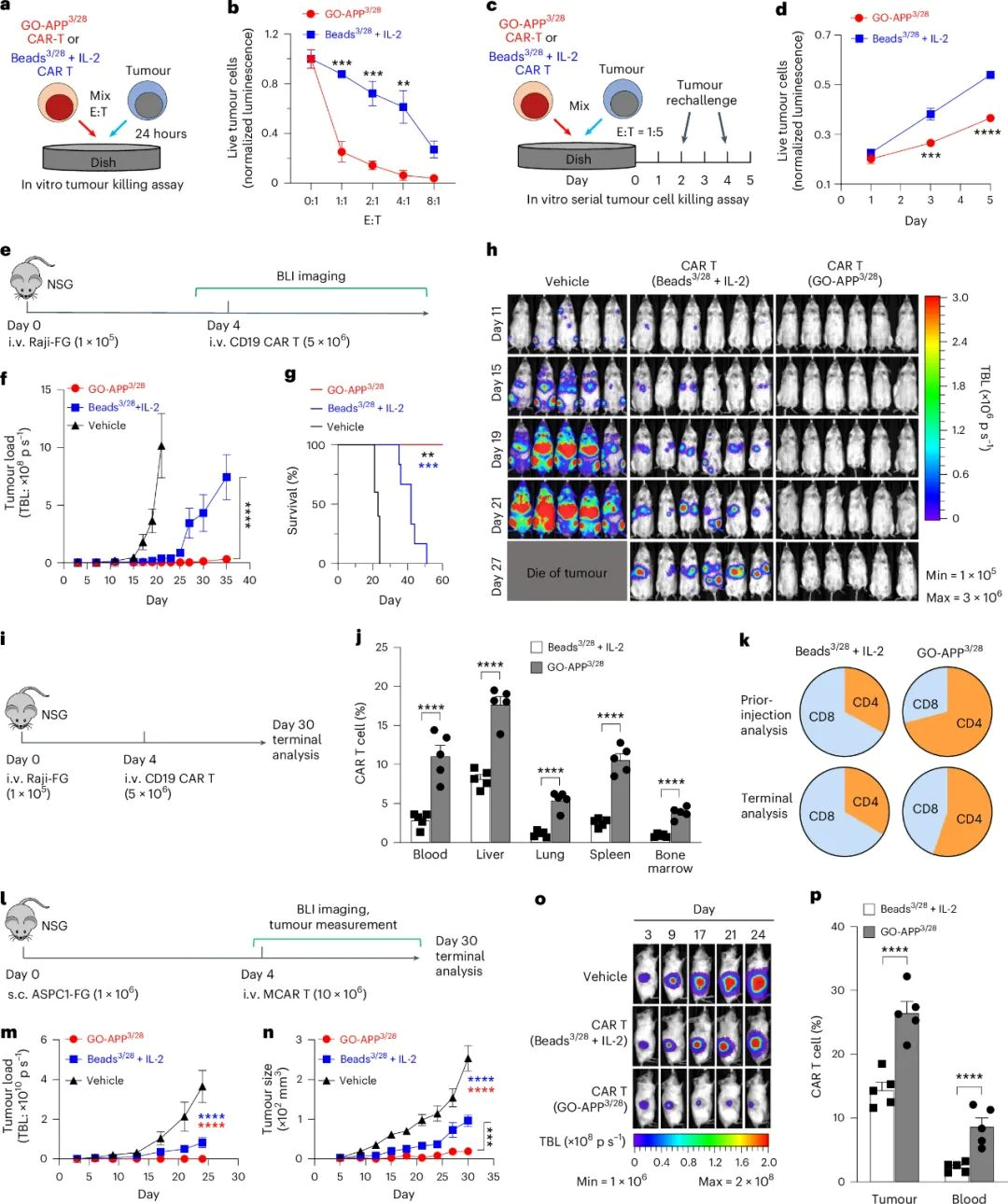
图3 | GO-APP3/28在CAR T细胞治疗癌症中的研究
GO-APP3/28刺激T细胞活化的机制
GO-APP3/28刺激的T细胞与Beads3/28相比,在基因表达上表现出显著差异,特别是在激活T细胞转录因子和信号传导通路方面。单细胞RNA测序显示,GO-APP3/28激活的T细胞与Beads3/28激活的T细胞形成两个不同的细胞簇。GO-APP3/28 T细胞在TCR、CD3、IL-2和CD28信号通路的基因表达上显著上调。GO-APP3/28 T细胞在这些关键信号通路的基因集富集程度更高,表明其在T细胞激活和扩增方面具有更强的效果。在CD8+和CD4+ T细胞亚群中,GO-APP3/28激活的细胞显示出更好的细胞因子产生和激活标志物。GO-APP3/28激活的CD8+ T细胞表现出更强的多功能性效应细胞表型,而CD4+ T细胞则显示出更高的细胞因子产生,特别是IL-2。此外,GO-APP3/28主要促进TH1和TH2功能,并未导致TH17或Treg细胞的极化。蛋白表达和磷酸化水平的增加进一步证实了GO-APP3/28在T细胞激活中的作用,特别是在TCR、CD28和IL-2信号通路中。这些发现揭示了GO-APP3/28在T细胞激活和抗癌细胞治疗中的潜力。
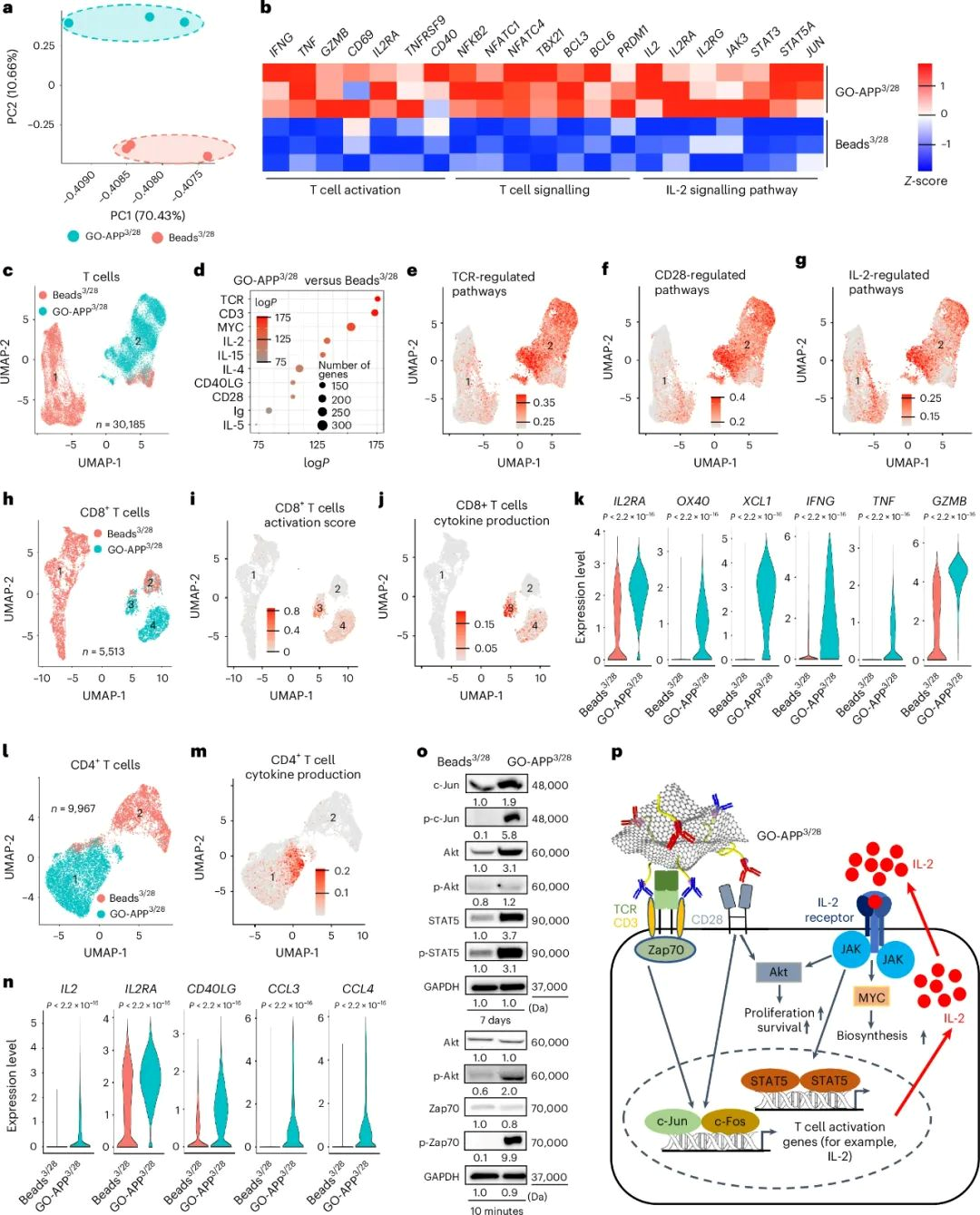
图4 | GO-APP3/28刺激T细胞激活的机制研究
小结:
总之,研究人员成功开发了GO-APP,这是一种基于GO的抗原呈递平台,设计灵活,制造坚固,应用广泛。潜在的应用包括将αCD3和αCD28抗体对接在GO-APP(GO-APP3/28)上,用于T细胞产品的制造。与之前使用固体表面、刚性珠、纳米棒或纳米管的方法相比,GO-APP3/28可以在细胞大小尺度上通过共形接触更好地模拟免疫突触。因此,GO-APP3/28可以实现高容量刺激T细胞扩增,同时保留强大的效应器功能。此外,它还使T细胞的CAR基因工程具有高效性。值得注意的是,GO-APP3/28刺激了强烈的自分泌IL-2的产生,克服了目前先进的Beads3/28对IL-2补充的依赖性。这导致了异常的T细胞扩增和多功能效应器样表型,从而在体外和体内转化为更好的肿瘤杀伤效果。当前GO-APP3/28的一个潜在限制是与最终细胞产物的分离。GO的生物相容性减轻了这种担忧,研究人员观察到GO-APP3/28在体外和体内均未引起毒性。一种可行的分离解决方案可能涉及将磁性纳米颗粒掺入GO-APP3/28。GO-APP代表了一种探索和调节细胞膜上信号蛋白相互作用的新方法。成功设计和优化GO-APP上抗原呈递的能力为开发用于免疫学研究和治疗应用的新型结构铺平了道路。
参考文献:
Zhu, E., Yu, J., Li, YR. et al. Biomimetic cell stimulation with a graphene oxide antigen-presenting platform for developing T cell-based therapies. Nat. Nanotechnol. (2024).
https://doi.org/10.1038/s41565-024-01781-4
信息来源:奇物论
氧化石墨烯:
氧化石墨烯(graphene oxide )是石墨烯的氧化物,一般用GO表示,其颜色为棕黄色,市面上常见的产品有粉末状、片状以及溶液状的。因经氧化后,其上含氧官能团增多而使性质较石墨烯更加活泼,可经由各种与含氧官能团的反应而改善本身性质。
氧化石墨烯薄片是石墨粉末经化学氧化及剥离后的产物,氧化石墨烯是单一的原子层,可以随时在横向尺寸上扩展到数十微米。因此,其结构跨越了一般化学和材料科学的典型尺度。氧化石墨烯可视为一种非传统型态的软性材料,具有聚合物、胶体、薄膜,以及两性分子的特性。氧化石墨烯长久以来被视为亲水性物质,因为其在水中具有优越的分散性,但是,相关实验结果显示,氧化石墨烯实际上具有两亲性,从石墨烯薄片边缘到中央呈现亲水至疏水的性质分布。因此,氧化石墨烯可如同界面活性剂一般存在界面,并降低界面间的能量。其亲水性被广泛认知。